Etats de la matière:
- Etat Solide : un solide possède un volume et une forme propres. \(\to\) Intéractions intermoléculaires fortes
- Etat Liquide : un liquide possède un volume qui lui est propre. Mais prend la forme du récipient \(\Rightarrow\) n'a pas de forme propre. \(\to\) Qlq intéractions (plus d'orde que le gaz mais plus libre que le solide)
- Etat Gazeux : Un gaz ne possède ni forme ni volume propre. Prend la forme du récipient qui le contient et occupe tout l'espace.\(\to\) Molécules indépendantes \(\iff\) Pas d'intéractions
\(\implies\) Expliqué par les interactions dipolaires ENTRE molécules.
Température:
- La temperature d'un milieu représente l'\(E_c\) moyenne des molécules
- Les \(T_{changement\,d'état}\) révèlent l'intensité des intéractions intermoléculaires
Forces d'intéraction dipolaire de Van der Waals:
Intéractions de KEESOM
Intéractions dipôle-dipôle
\(\to\)Entre 2 (molécules polaires) dipoles permanents
\(\to\)Dépend de la température (plus forte quand basse)
\(\to\)A courte distance
Intéractions de DEBYE:
Polarisabilité (\(\alpha\)): aptitude à déformer son nuage électronique
\(\to\) Augmente avec la taille d'une molécule (ou masse molaire)
Interaction « dipôle permanent – dipôle induit »
Le champ électrique produit par le dipole permanent d'une molécule polaire
\(\to\) déforme le nuage molécule apolaire
\(\Rightarrow\) molécule se polarise
\(\Rightarrow\) dipole induit
\(\Rightarrow\)Interaction de DEBYE entre moment dipolaire permanent et induit
Intéractions de dispersion de LONDON:
Toujours présente
Explique les composés apolaire (ex: \(o-2\))
\(\longrightarrow\) Interaction « dipôle instantané – dipôle induit »
Moment dipolaire instantané:
- Molécules apolaire \(\iff\) barycentres confondus \(\iff\) moment dipolaire permanent nul
- À un instant t \(\to\) mouv aléatoire \(e^-\) \(\Rightarrow\)barycentres non-confondues
\(\Rightarrow\) dipole instantané
Moment dipolaire instantané crée un dipole induit à molécule apolaire
Liaison hydrogène
Attraction électrostatique dipole-dipole entre un atome hydrogène d'une molécule et un doublet non-liant (tout 2 électronégatif)
\(\to\)Possible dans une molécule seule
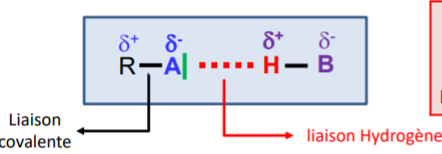
Energie ++supérieur autres
Reponsable de:
- Température de changement d'etat élevé
- Solubilité
- Viscosité
- Dureté
Remarque sur l'intéraction faible
- Très courte portée (échelle du noyau atomique)
- Très peu intense
- Reponsable de désintégration radioactive de certaines particules